Большой передел мира
266,668,044
521,971

село Хайфа
Карма: +2,960.06
Регистрация: 10.06.2008
Сообщений: 10,054
Читатели: 0
Регистрация: 10.06.2008
Сообщений: 10,054
Читатели: 0
Цитата: DeC от 17.04.2020 18:13:22Помео заявил Лаврову, что переговоры о контроле вооружения должны включать Китай.
Американский госсекретарь Майк Помпео провел телефонный разговор с министром иностранных дел России Сергеем Лавровым. Политики обсудили шаги в двустороннем диалоге по стратегической стабильности. Помпео заявил, что любые будущие переговоры о контроле над вооружениями должны включать КНР.
Ага, а так же, кроме Китая, должны включать в себя Великобританию, Францию, ну и на сладкое - Израиль

Россия, это в том числе евреи, Вам не нравятся евреи? Значит Вам не нравится Россия (с)Перегрев

Карма: +420,734.59
Регистрация: 19.01.2009
Сообщений: 281,521
Читатели: 55
Регистрация: 19.01.2009
Сообщений: 281,521
Читатели: 55
Под хештегом #StrongerTogether все ведомственные твиттер-аккаунты НАТО начали яростно постить о своих беспрецедентных мерах по оказанию помощи союзным странам в борьбе с пандемией. Таким образом в альянсе пытаются развенчивать упомянутые ранее мифы, в данном случае - миф о неспособности НАТО обеспечить поддержку странам-членам альянса.


Язык ненависти оказывает сдерживающий эффект на демократический дискурс в онлайн-среде. (c) Еврокомиссия

Карма: +420,734.59
Регистрация: 19.01.2009
Сообщений: 281,521
Читатели: 55
Регистрация: 19.01.2009
Сообщений: 281,521
Читатели: 55
В Сирию сегодня пришла гуманитарная медицинская помощь из России с обещанием дослать 150 аппаратов ИВЛ до конца апреля.




Язык ненависти оказывает сдерживающий эффект на демократический дискурс в онлайн-среде. (c) Еврокомиссия

Москва
61 год
Карма: +266.44
Регистрация: 08.02.2012
Сообщений: 679
Читатели: 0
Регистрация: 08.02.2012
Сообщений: 679
Читатели: 0
Цитата: rezkiy от 17.04.2020 20:24:20Дефолта (такого) не будет, ФРС уже обьявила что купит ВСЕ. То, о чем Вы говорите, наступит тогда, когда исчезнет не доверие к доллару (его уже почти нет после недавнего цирка), а зависимость от него.
Именно с этим связана ошибка Авантюриста в сроках. Он их уравнил. Был прав почти во всем, но даже в страшном сне не мог представить, что легким нажатием кнопок можно создать 6трлн$ и все это проглотят.
А мы тут дружно улыбались над КУЕ 1.2.3... Ню-ню...
Пы.Сы. У Китая чуть больше 1трлн, а не 2. Он на втором месте. На первом Япония по кол-ву макулатуры.
Быть правым почти во всем? И? На этих прогнозах пережеваны тетрабайты ожиданий .
 Но, есть нюанс, даже в страшном сне не мог представить..... Именно в этом слабые коленки у всех прогнозистов из "новоделов". Не стеб и не оскорбление. Просто есть большие коллективы людей, веками кующие реальность. В их руках столетиями реальные механизмы управления и ресурсы, колоссальный опыт. Т.е. надеяться, что те правила "как работает экономика и где яйцо кощщея", которые складывались в головы прогнозистов-новоделов, не догма для реальных коллективов, веками кующих ... Все модели прогнозов от новоделов на несколько шагов сзади от принятых и реализуемых задач и, допускаю, весьма далеки от понимания , какими заготовками их может порадовать суровая действительность. А так да, прогнозист туда, прогнозист сюда.
Но, есть нюанс, даже в страшном сне не мог представить..... Именно в этом слабые коленки у всех прогнозистов из "новоделов". Не стеб и не оскорбление. Просто есть большие коллективы людей, веками кующие реальность. В их руках столетиями реальные механизмы управления и ресурсы, колоссальный опыт. Т.е. надеяться, что те правила "как работает экономика и где яйцо кощщея", которые складывались в головы прогнозистов-новоделов, не догма для реальных коллективов, веками кующих ... Все модели прогнозов от новоделов на несколько шагов сзади от принятых и реализуемых задач и, допускаю, весьма далеки от понимания , какими заготовками их может порадовать суровая действительность. А так да, прогнозист туда, прогнозист сюда.

Москва-Казань
Карма: +1,518.21
Регистрация: 22.12.2019
Сообщений: 1,900
Читатели: 1
Регистрация: 22.12.2019
Сообщений: 1,900
Читатели: 1
Цитата: DeC от 16.04.2020 21:33:28Так написано в приказе:Скрытый текст
Речь идет о возможности применения на территории РФ препарата, который поставила КНР на безвозмездной основе в кол-ве 68600 упаковок.
Надо же как то эту помощь использовать.Вот ее и ЛЕГАЛИЗАВАЛИ
Точка. Все. Только 68600 упаковок.
"Если на клетке слона прочтешь надпись: буйвол, — не верь глазам своим" - Козьма Прутков

Петропавловск-Камчатский
44 года
Карма: +3,667.96
Регистрация: 17.08.2008
Сообщений: 12,423
Читатели: 8
Регистрация: 17.08.2008
Сообщений: 12,423
Читатели: 8
Цитата: dmitriк62 от 17.04.2020 18:49:25А что, у королька уже нет денег, промотал всё в Баварии с блэкджеком и шлюхами?
Ну столько физически промотать нельзя.
Просто тайские нацисты сильно недолюбливали фарангов. Но выгнав их всех из страны видимо ощутили примерно такие же проблемы как и приграничные районы финки - нет туристов - нет денег.
Это конечно не фатальная проблема и за год-два - вполне можно решить проблему. Все таки и сх и производство там отнюдь не бумажные. Но в моменте (тем боле при таких радикальных мерах) - проблемы думаю там вылезли очень не шуточные.
Рожденный ползать - не мешайся на взлетной полосе.

Москва-Казань
Карма: +1,518.21
Регистрация: 22.12.2019
Сообщений: 1,900
Читатели: 1
Регистрация: 22.12.2019
Сообщений: 1,900
Читатели: 1
Цитата: Eliseevna от 17.04.2020 16:47:08Может туда вывезли наших детдомовцев?
Если это дети до 18 лет, то вывезти детдомовцев через погранконтроль будет невозможно вследствие отсутствия согласия родителей (органа опеки)
"Если на клетке слона прочтешь надпись: буйвол, — не верь глазам своим" - Козьма Прутков

провинция
64 года
Карма: +30,395.37
Регистрация: 29.10.2013
Сообщений: 30,264
Читатели: 94
Регистрация: 29.10.2013
Сообщений: 30,264
Читатели: 94
Цитата: DeC от 17.04.2020 20:55:46Под хештегом #StrongerTogether все ведомственные твиттер-аккаунты НАТО начали яростно постить о своих беспрецедентных мерах по оказанию помощи союзным странам в борьбе с пандемией. Таким образом в альянсе пытаются развенчивать упомянутые ранее мифы, в данном случае - миф о неспособности НАТО обеспечить поддержку странам-членам альянса.
НАТЫ перевезли по всему миру....25 полевых госпиталей...25 тыс. коек, 4 тыс.рыл медперсонала...
Так сразу и вспоминается "Куртка замшевая... тоже три"..
Пы.Сы. Этот бред - для малолетних дебилов (коими, без сомнения, является большинство граждан государств-членов НАТО)
Пусть лучше расскажут, как украинская "Мрия" (МРИЯ, Карл!!! самый грузоподъемный самолет в мире) привеза в Варшаву из Китая АЖ 9 )ДЕВЯТЬ, Карл!!) ТОНН МЕДИЦИНСКИХ МАСОК
Рейс организовало НАТО
Сказать, что поляки, получив груз, просто ОХУ.. ОТОРОПЕЛИ - значит ничего не сказать

Карма: +30,740.10
Регистрация: 14.09.2010
Сообщений: 18,708
Читатели: 82
Глобальный Модератор
Регистрация: 14.09.2010
Сообщений: 18,708
Читатели: 82
Глобальный Модератор
Цитата: Born Rules от 17.04.2020 11:31:30Прямо таки исторические аналогии возникают.
Джанибек забросил зараженные трупы в осаждённую Кафу. Там начался мор. Бежавшие оттуда генуэзцы занесли его в Византию и Италию. Оттуда мор пошел по всей Европе, примерно через год достиг Новгорода и оттуда пошел по Руси, уморив, в том числе великого князя Семёна Гордого со всем семейством. А из Руси мор пришел уже в Орду.
Собственно, совершив круговорот, мор вернулся в точку своего старта.
Да и не надо даже в такие исторические глубины нырять.
Полная калька с ныне активно юзаемой методички.
Как Россию и так и этак из разных утюгов призывают признаться что в скрипалевщине, что в причастности к сбитию боинга над Донбассом.
Но, столь любимая нашим коллегой DeCом, постправда уже хреново работает.
Поистрепали как ту половую тряпку в вокзальном сортире. Несет от нее.
И во всем мире нашу пословицу про то, кто громче всех кричит "Держи вора", когда на нем шапка горит, многие уже впитали.
Не получится у них с Китаем ни хрена, как бы не гундосили. На этот гундеж уже и до начала коронавакханалии мало кто внимания обращал, а теперь и тем более.
Даже в песочнице Золотого Миллиарда, не говоря уже о мире, это только политиков их же волновать начинает.
Этакая мастурбация в салонах для истеблишмента, даже собственный лохтократ поиметь не получается, ему все больше пфуй на гегемонство, когда от него последние штаны трескаться начинают. Так и мастурбируют в своем мирке истеблишмнутые друг на друга, а то что крики на всю вселенную разносятся ... "Дас ист фантастишь", так пипл это не только уже не хавает, ему на это просто пфуй было бы, вот только крики эти раздражают. Но это пока в салонах динамики, на улицу орущие, не отключили...
Отредактировано: Сизиф - 18 апр 2020 00:10:53
"Но они должны понять, что бал вампиров заканчивается". В.В. Путин
Всё будет хорошо. Готовьтесь... Серьезно готовьтесь...
Ибу ибу ди - хуэй дао муди!
И тем шире шагайте, чем лучше подготовились.
Всё будет хорошо. Готовьтесь... Серьезно готовьтесь...
Ибу ибу ди - хуэй дао муди!
И тем шире шагайте, чем лучше подготовились.

Карма: +30,740.10
Регистрация: 14.09.2010
Сообщений: 18,708
Читатели: 82
Глобальный Модератор
Регистрация: 14.09.2010
Сообщений: 18,708
Читатели: 82
Глобальный Модератор
Цитата: DeC от 17.04.2020 11:45:1710:45 17.04.2020
МОСКВА, 17 апр - РИА Новости. Президент Бразилии Жаир Болсонару обвинил спикера нижней палаты парламента Родриго Майя в том, что он настроил губернаторов против него, и в желании сместить нынешнее правительствоСкрытый текст
Болсонару изображает из себя Лукашенко, но там на него нашелся смелый политик.
Не столько даже Лукашенко напоминает ситуация.
История ведь развивается по спирали. Вот только витки ее сейчас стремительно сжимаются. Не Болсонару ли был главным закоперщиком из ЛА (ну кроме соседки-наркоманки Венесуэлы, но у ней и весу даже в ЛА хрен да ни хрена) давеча и против Мадуро топил за Гуайдо.
Пожалте, на следующем витке уже в Бразилии скачет Майя, черпайте двумя руками и не обляпайтесь,
А вот не хрен было ворота сдвигать....
"Но они должны понять, что бал вампиров заканчивается". В.В. Путин
Всё будет хорошо. Готовьтесь... Серьезно готовьтесь...
Ибу ибу ди - хуэй дао муди!
И тем шире шагайте, чем лучше подготовились.
Всё будет хорошо. Готовьтесь... Серьезно готовьтесь...
Ибу ибу ди - хуэй дао муди!
И тем шире шагайте, чем лучше подготовились.

Карма: +420,734.59
Регистрация: 19.01.2009
Сообщений: 281,521
Читатели: 55
Регистрация: 19.01.2009
Сообщений: 281,521
Читатели: 55
Федеральные власти США заторопились с началом процедуры перевода экономики в рабочее состояние.
В Белом доме представили дорожную карту под названием “Снова открыть Америку”. Она включает в себя три фазы. На первом этапе предусматривается сохранение режима самоизоляции, но с возможностью работы бизнеса. На втором разрешаются передвижения по штату и за его пределами. На третьем этапе уже снимаются все оставшиеся ограничения.
Эта карта была показана спустя лишь один день после начала массовых протестов против карантинных мер в нескольких штатах - Мичигане, Северной Каролине и Вайоминге. Местная власть уже пошла на компромиссы: например, шерифы Мичигана отказались обеспечивать соблюдение самых жестких решений, принятых тамошним губернатором.
По словам Дональда Трампа, от трети до половины штатов уже квалифируются для попадания в первый этап “открытия Америки”. Там режим самоизоляции будет смягчаться в ближайшие дни. Остальным придется дождаться стабилизации ситуации с эпидемией, прежде чем приступать к запуску экономики.
Пока полным ходом идут работы по созданию экспериментальной вакцины от коронавируса, её выход на рынок ожидается осенью. Тем временем появляются всё большее число перспективных препаратов для лечения COVID-19.
В частности, правительство США теперь возлагает большие надежды на антивирусное средство “Ремдеcивир” от фирмы Gilead, используемое при Эболе. Предварительные тесты установили, что оно помогает излечивать больных коронавирусов буквально за 5-7 дней.

//Малек Дудаков

В Белом доме представили дорожную карту под названием “Снова открыть Америку”. Она включает в себя три фазы. На первом этапе предусматривается сохранение режима самоизоляции, но с возможностью работы бизнеса. На втором разрешаются передвижения по штату и за его пределами. На третьем этапе уже снимаются все оставшиеся ограничения.
Эта карта была показана спустя лишь один день после начала массовых протестов против карантинных мер в нескольких штатах - Мичигане, Северной Каролине и Вайоминге. Местная власть уже пошла на компромиссы: например, шерифы Мичигана отказались обеспечивать соблюдение самых жестких решений, принятых тамошним губернатором.
По словам Дональда Трампа, от трети до половины штатов уже квалифируются для попадания в первый этап “открытия Америки”. Там режим самоизоляции будет смягчаться в ближайшие дни. Остальным придется дождаться стабилизации ситуации с эпидемией, прежде чем приступать к запуску экономики.
Пока полным ходом идут работы по созданию экспериментальной вакцины от коронавируса, её выход на рынок ожидается осенью. Тем временем появляются всё большее число перспективных препаратов для лечения COVID-19.
В частности, правительство США теперь возлагает большие надежды на антивирусное средство “Ремдеcивир” от фирмы Gilead, используемое при Эболе. Предварительные тесты установили, что оно помогает излечивать больных коронавирусов буквально за 5-7 дней.

//Малек Дудаков

Язык ненависти оказывает сдерживающий эффект на демократический дискурс в онлайн-среде. (c) Еврокомиссия

Карма: +420,734.59
Регистрация: 19.01.2009
Сообщений: 281,521
Читатели: 55
Регистрация: 19.01.2009
Сообщений: 281,521
Читатели: 55
Трамп призвал американцев фактически браться за оружие, чтобы добиться снятия ограничений по коронавирусу.
В серии твитов президент США обратился к жителям Мичигана, Миннесоты и Вирджинии с призывом не подчиняться указам о принудительной изоляции и «ОСВОБОЖДАТЬ» (LIBERATE) штаты, а также «сохранить нашу замечательную вторую поправку о праве на ношение оружие, которой нас лишили».
Это произошло на следующий день после того, как Трамп предложил губернаторам план по открытию экономики - на их усмотрение по срокам, и отступился от своей неконституционной идеи о том, что у президента США «власть абсолютна».
Жители этих штатов действительно вчера вышли на протесты.
Думаю, теперь мы знаем, что нас ждет в ноябре.

В серии твитов президент США обратился к жителям Мичигана, Миннесоты и Вирджинии с призывом не подчиняться указам о принудительной изоляции и «ОСВОБОЖДАТЬ» (LIBERATE) штаты, а также «сохранить нашу замечательную вторую поправку о праве на ношение оружие, которой нас лишили».
Это произошло на следующий день после того, как Трамп предложил губернаторам план по открытию экономики - на их усмотрение по срокам, и отступился от своей неконституционной идеи о том, что у президента США «власть абсолютна».
Жители этих штатов действительно вчера вышли на протесты.
Думаю, теперь мы знаем, что нас ждет в ноябре.

Язык ненависти оказывает сдерживающий эффект на демократический дискурс в онлайн-среде. (c) Еврокомиссия

Питер
Карма: +2,641.57
Регистрация: 31.01.2008
Сообщений: 6,547
Читатели: 2
Регистрация: 31.01.2008
Сообщений: 6,547
Читатели: 2
Цитата: xrvr от 17.04.2020 23:26:55Лидируют они сейчас, это точно.
5 стран из G7 имеют 1,265,000 зараженных, или больше половины всего оставшегося мира.
При этом там проживает только 15% всего населения земли.
Кстати, Англия по смертности уже перегнала Италию. Что у них там творится?
Как обогнала? 14 тыс в Англии 22 в Италии. Еще не близко
Карма: +26.00
Регистрация: 16.04.2020
Сообщений: 153
Читатели: 0
Регистрация: 16.04.2020
Сообщений: 153
Читатели: 0
Цитата: avt5160701 от 17.04.2020 19:28:03А теперь сравним вот с этой новостью:
Си Цзиньпин открыл VII Всемирные военные игры в Ухане.
Си Цзиньпин открыл VII Всемирные военные игры в Ухане
16:28 18.10.2019 (обновлено: 19:37 18.10.2019)
3688
© РИА Новости / Жанна Манукян
УХАНЬ (Китай), 18 окт - РИА Новости. Председатели КНР Си Цзиньпин объявил VII Всемирные военные игры открытыми, передает корреспондент РИА Новости.
Церемония открытия Игр состоялась в Уханьском спортивном центре в провинции Хубэй.
"Я объявляю VII Всемирные военные игры открытыми", - сказал Си Цзиньпин.VII Всемирные летние военные игры пройдут в городе Ухань китайской провинции Хубэй с 18 по 27 октября 2019 года. По данным организаторов, в них примут участие более 9300 военных из 109 стран, что является рекордом за всю историю. Соревнования пройдут по 329 дисциплинам в 27 видах спорта.Подробности
В состав сборной ВС России на предстоящих Играх вошли 257 спортсменов, они выступят в 23 видах спорта.
Игры проходят под эгидой Международного совета военного спорта (CISM), созданном в феврале 1948 года.
.
https://ria.ru/20191018/1559946032.html
.
Добавим две недели и получаем:
Первый случай коронавируса был зафиксирован в Китае в ноябре.Первый случай инфицирования новым коронавирусом COVID-19 в Китае был зафиксирован 17 ноября 2019 года. Об этом пишут местные СМИ со ссылкой на правительственные документы.
Первым заболевшим был 55-летний житель провинции Хубэй. После этого каждый день заболевали до 5 человек. К середине декабря инфицировались 27 человек, к 1 января – уже 381.
Ранее Всемирная организации здравоохранения сообщала, что первый случай заражения новым коронавирусом был зафиксирован в Китае 8 декабря, передает ТАСС.
.
https://www.vesti.ru/doc.html?id=3247671&utm_source=yxnews&utm_medium=desktop&utm_referrer=https%3A%2F%2Fyandex.ru%2Fnews
.
Вот моя версия, оттуда всё и понеслось. Чихнули или подмешали в еду или воду на играх, потом кто-то из обслуги зашел на рынок и плеснул там, чтобы отвести подозрения. Отсюда и первые заболевшие в Иране, это потом уже начали плескать в Италии и во всех других местах.
Я хоть и не разведка и не Фокс Ньюз, но моя версия гораздо стройнее всех их вместе взятых.
Ухань шокирован необъяснимой пневмонией, что думают врачи-респираторы?

sunkkk
Опубликовано 2019-12-31 16:50 с
Вечером 30-го в Интернете было размещено экстренное уведомление под названием «Относительно лечения пневмонии по неизвестной причине». Рыжий документ Медицинского и медицинского управления Управления Уханьской муниципальной комиссии по здравоохранению и здравоохранению был широко распространен в Интернете, и последовали различные заявления. Некоторые люди начали нервничать.
Репортер позвонил на официальную горячую линию Уханьской городской комиссии по здравоохранению 12320 утром 31-го и узнал, что содержание документа соответствует действительности.
Что такое необъяснимая пневмония?
«Неизвестная причина пневмонии» - это термин, предложенный Министерством здравоохранения для более эффективного выявления и лечения ОРВИ, человеческого птичьего гриппа и других аналогичных инфекционных пневмоний во время после эпидемии атипичной пневмонии в 2002 году.
Строго говоря, «необъяснимая пневмония» не является строгой медицинской концепцией, но она все еще имеет определенное значение как тип пневмонии, которая имеет определенные особые клинические проявления и определенную инфекционность, такую как SARS и птичий грипп человека. Это очень важно для оперативного выявления подозрительных случаев, раннего предупреждения и соответствующих мер профилактики и контроля, а также для раннего предупреждения. С 2003 года Министерство здравоохранения разработало «Национальный план осуществления по эпиднадзору за необъяснимыми случаями пневмонии (судебное разбирательство)». Существует много видов пневмонии, и страна контролирует ее каждый год. ,
Диагностические критерии для необъяснимых случаев пневмонии
1. Лихорадка (≥38 ℃);
2. Визуализация особенностей пневмонии или острого респираторного дистресс-синдрома;
3. Общее количество лейкоцитов на ранней стадии заболевания снижается или становится нормальным или классификация лимфоцитов уменьшается;
4. После стандартного лечения антибиотиками в течение 3-5 дней состояние значительно не улучшилось.
Что должен делать врач, если в больнице обнаружена необъяснимая пневмония?
Скрытый текст
Отредактировано: FROGRAmm - 18 апр 2020 00:23:13
"He who controls the past controls the future. He who controls the present controls the past."
George Orwell
George Orwell

Карма: +30,740.10
Регистрация: 14.09.2010
Сообщений: 18,708
Читатели: 82
Глобальный Модератор
Регистрация: 14.09.2010
Сообщений: 18,708
Читатели: 82
Глобальный Модератор
Цитата: неГуффи_аРегуляр от 17.04.2020 13:41:50Смешные "разведчики" в Америке.
Израиль предупредили, а свои власти не стали.
Ведь это основной повод для наезда на Китай - МАГА ничего не знала и не успела поэтому подготовится.
Это будет вторая часть марлезонского балета.
Разведка знала и послала в Белый Дом емейл. Но злобные русскиехакерытм его перехватили.
Потому и Россия тоже должна.
"Но они должны понять, что бал вампиров заканчивается". В.В. Путин
Всё будет хорошо. Готовьтесь... Серьезно готовьтесь...
Ибу ибу ди - хуэй дао муди!
И тем шире шагайте, чем лучше подготовились.
Всё будет хорошо. Готовьтесь... Серьезно готовьтесь...
Ибу ибу ди - хуэй дао муди!
И тем шире шагайте, чем лучше подготовились.
Карма: +26.00
Регистрация: 16.04.2020
Сообщений: 153
Читатели: 0
Регистрация: 16.04.2020
Сообщений: 153
Читатели: 0
Цитата: Технарь_ от 17.04.2020 21:48:12А теперь добавьте в Вашу версию статью "коллектива авторов" от 2015 года о коронавирусах летучих мышей, Ссылка на саму статью
и информацию об американской военнослужащей, упавшей во время велогонки:
а также о судьбе американской лаборатории, идентичной уханьской, также занимавшейся этой темой, и особенно о причинах её закрытия, и тогда американская разведка вместе с фокс ньюз жалобно заскулят в уголке, кусая пальцы....
Китайский врач арестован за оповещение о коронавирусе
Мы все в долгу перед ним, потому что д-р Ли Вэньлян был одним из восьми осведомителей Ухани, которые предупредили общественность о вспышке коронавируса.
Хелен Роли, Хелен Роли
10 февраля 2020 г.
Если вы никогда не слышали о докторе Ли Вэньляне, его историю стоит знать. В какой-то степени мы все должны ему нашу благодарность, потому что Ли был одним из восьми Уханьских осведомителей, которые предупредили общественность о вспышке коронавируса.
Китайские власти знали о случаях пневмонии в Ухане еще с 1 декабря. Вместо того, чтобы предупредить общественность о необходимости принять надлежащие меры предосторожности против вируса, они скрыли эту информацию и скрыли эту новость.
30 декабря 2019 года д-р Ли, респектабельный офтальмолог в больнице в Ухане, эпицентре коронавируса, поделился тревожными новостями со своей группой выпускников медицинской школы: нескольким лицам, имевшим контакт с рынком морепродуктов Хуа Нана, был поставлен диагноз SARS-подобные случаи и помещены на карантин в больницу, где он работал. Ли предупредил своих друзей и коллег, чтобы начать принимать дополнительные меры предосторожности. Оказалось, что семь других медицинских работников также сообщили в социальных сетях о коронавирусе в Ухане.
Китайские власти, которые в конечном итоге не смогли больше прикрыть вспышку, были вынуждены предупредить Всемирную организацию здравоохранения о новом вирусе 31 декабря 2019 года. Вопрос о том, сколько еще китайское правительство будет ждать, чтобы предупредить ВОЗ, если нет для восьми осведомителей, мужественно делящихся новостями, остается неизвестным.
Тем не менее, ВОЗ похвалила китайское правительство за «прозрачность», однако полиция Уханя начала собирать Ли и других врачей на Новый год для «фабрикации, распространения и распространения слухов». Каждый был вынужден подписать заранее написанное, сфабрикованное признание, признавая свои «проступки» и обещая никогда больше этого не делать.
После освобождения Ли немедленно возобновил работу в больнице. Он закончил тем, что заболел коронавирусом после лечения зараженного пациента, которого он не знал, был заражен в то время. Ли был госпитализирован 12 января.https://thefederalist.com/2020/02/10/chinese-doctor-arrested-for-alerting-world-about-coronavirus-dies-a-hero/
Появление и вспышка недавно обнаруженного острого респираторного заболевания в Ухане, Китай, затронули более 40 000 человек и убили более 1000 человек по состоянию на 10 февраля 2020 г. Новый человеческий коронавирус, SARS-CoV-2, был быстро идентифицирован и ассоциированное заболевание в настоящее время называется коронавирусной болезнью, обнаруженной в 2019 году (COVID-19) ( https://globalbiodefense.com/novel-coronavirus-covid-19-portal/ ).
Согласно сообщениям [ 1–3 ], COVID-2019, похоже, имеет сходные клинические проявления с симптомами тяжелого острого респираторного синдрома (SARS), вызванного SARS-CoV. Последовательность генома SARS-CoV-2 также имеет ≥80% -ную идентичность с SARS-CoV, но она наиболее сходна с некоторыми бета-коронавирусами летучих мышей, причем самая высокая -> 96% -ная идентичность [ 4 , 5 ].
В настоящее время существуют предположения, слухи и теории заговора о том, что SARS-CoV-2 имеет лабораторное происхождение. Некоторые люди утверждают, что человеческий SARS-CoV-2 был получен непосредственно из лаборатории в Ухани, где недавно было сообщено о летучей мыши CoV (RaTG13), которая разделяла гомологию на 96% с SARS-CoV-2 [ 4 ].
Скрытый текст
https://www.tandfonline.com/doi/full/10.1080/22221751.2020.1733440
Отредактировано: FROGRAmm - 18 апр 2020 00:52:25
"He who controls the past controls the future. He who controls the present controls the past."
George Orwell
George Orwell

Карма: +30,740.10
Регистрация: 14.09.2010
Сообщений: 18,708
Читатели: 82
Глобальный Модератор
Регистрация: 14.09.2010
Сообщений: 18,708
Читатели: 82
Глобальный Модератор
Цитата: DeC от 17.04.2020 14:15:45Скрытый текст
«Я считаю, что это действительно имеет значение. Есть множество высококвалифицированных женщин, у которых достаточно знаний и опыта, чтобы немедленно занять пост президента. И я продолжаю придерживаться этой позиции», – подчеркнул он.
Это что, типа оговорка по Фрейду?
Он что, собирается избраться и "немедленно" отправиться в мир иной...
Мыслями уже там... среди гурий
А здесь только вон всякой чухней отвлекают...митинги, дебаты, интервью...
Отредактировано: Сизиф - 18 апр 2020 02:52:33
"Но они должны понять, что бал вампиров заканчивается". В.В. Путин
Всё будет хорошо. Готовьтесь... Серьезно готовьтесь...
Ибу ибу ди - хуэй дао муди!
И тем шире шагайте, чем лучше подготовились.
Всё будет хорошо. Готовьтесь... Серьезно готовьтесь...
Ибу ибу ди - хуэй дао муди!
И тем шире шагайте, чем лучше подготовились.

Нью Йорк
44 года
Карма: +3,773.36
Регистрация: 21.10.2009
Сообщений: 5,124
Читатели: 32
Регистрация: 21.10.2009
Сообщений: 5,124
Читатели: 32
Источник не публичный, поэтому ссылок не даю
ЦитатаФедеральное стимулирование. Отмена плановых операций, которые большинство штатов распорядились сделать к кризису COVID-19, оказывает влияние на финансы больниц. Одним из первых признаков этого являются опубликованные ранее в этом месяце данные о занятости в секторе здравоохранения, которые свидетельствуют о снижении занятости в сфере здравоохранения в США на 43 000 в марте. Это только 5-й и самый большой (4х) спад за последние 30 лет.
Законопроект о стимулах (№ 3), принятый Конгрессом 27 марта, предвидел эту проблему и включал гранты в размере 100 миллиардов долларов для больниц, чтобы помочь компенсировать сокращение доходов и увеличение расходов, с которыми сталкиваются поставщики. Закон также увеличивает выплаты Medicare больницам на лечение пациентов с COVID-19 на 20%, устраняет ряд сокращений выплат больницам от Medicare; и разрешает компаниям откладывать выплату налогов на социальное обеспечение до конца года.
До настоящего времени 30 миллиардов долларов грантового финансирования было распределено на основе того сколько счетов выставляти больницы по программе Medicare на 2019 год (более высокая оплата по программе Medicare в 2019-м, соответственно больше долларов США грантового финансирования сейчас). Формула распределения оставшихся 70 миллиардов долларов и сроки пока не обнародованы. Кроме того, Centers for Medicare and Medicaid Services (CMS) предоставили больницам, беспроцентный кредит на 12 месяцев, выплатив более 30 миллиардов долларов авансовых платежей.
Каждое из этих действий поможет больницам справиться с финансовым кризисом, который они испытывают из-за переноса плановых операций в большинстве штатов, чтобы сосредоточиться на лечении COVID-19.
Вы также должны ожидать, что Стимул № 4 в следующем месяце или около того, и демократы настаивают на добавлении еще 100 миллиардов долларов для больниц.
Рекомендации Белого дома по открытию экономики. Вчера администрация выпустила федеральные рекомендации по открытию экономики. Это предложение рекомендует показатели здравоохранения для восстановления экономики; трехэтапный подход к постепенному ослаблению текущих ограничений для предприятий и частных лиц; и важные области, где работодатели должны разработать политику безопасного возвращения в офис. Несколько мыслей:
1. Каждый штат будет принимать решения об открытии индивидуально и определит правильные процедуры и сроки для поэтапного открытия;
2. Повторное открытие будет сложным, так как каждый штат будет двигаться с разной скоростью и иметь разные варианты того, как открыть; и
3. Это займет время и может быть несколько неудач, поскольку люди вступают в более тесный контакт друг с другом.
Отредактировано: Доктор Удмурт - 18 апр 2020 04:21:33
Маджулá Сингапурá!

Санкт-Петербург
24 года
Карма: +20,309.88
Регистрация: 07.01.2009
Сообщений: 19,578
Читатели: 20
Регистрация: 07.01.2009
Сообщений: 19,578
Читатели: 20
1 этап снятия карантина 27 апреля, второй - 11 мая.
График Швейцарии по количеству случаев за день:
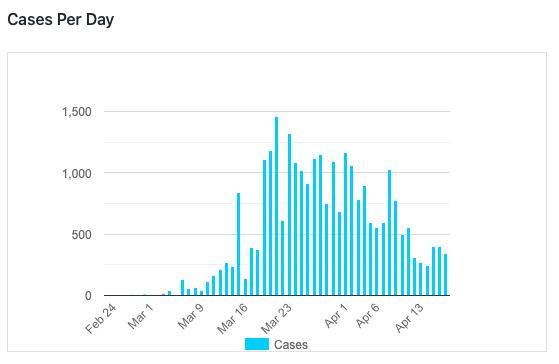
За вчера: 27078 выявленных +346 +129%
График Швейцарии по количеству случаев за день:

За вчера: 27078 выявленных +346 +129%
Отредактировано: NavyGator - 18 апр 2020 04:54:26
Мы летим вперед, а глядим назад.
Какой раньше рай! Какой раньше ад!
Мой родной народ, оглянись вперед!
Андрей Вознесенский, 1981
Какой раньше рай! Какой раньше ад!
Мой родной народ, оглянись вперед!
Андрей Вознесенский, 1981

Карма: +3,777.45
Регистрация: 19.08.2014
Сообщений: 2,336
Читатели: 12
Регистрация: 19.08.2014
Сообщений: 2,336
Читатели: 12
Цитата: DeC от 18.04.2020 00:13:45Трамп призвал американцев фактически браться за оружие, чтобы добиться снятия ограничений по коронавирусу.
В серии твитов президент США обратился к жителям Мичигана, Миннесоты и Вирджинии с призывом не подчиняться указам о принудительной изоляции и «ОСВОБОЖДАТЬ» (LIBERATE) штаты, а также «сохранить нашу замечательную вторую поправку о праве на ношение оружие, которой нас лишили».
Это произошло на следующий день после того, как Трамп предложил губернаторам план по открытию экономики - на их усмотрение по срокам, и отступился от своей неконституционной идеи о том, что у президента США «власть абсолютна».
Жители этих штатов действительно вчера вышли на протесты.
Думаю, теперь мы знаем, что нас ждет в ноябре.
Может и раньше.
Сотни протестующих откликнулись на призыв Трампа.
Думается будут и тысячи.
Интересно если экономика сможет осилить производство нарукавных повязок... иначе как знать какой штурмовик свой а какой чужой?
А вот почему он хочет открывать Мичиган уже 1го Мая это я не понимаю. Данный штат – 4й по количеству больных, 3й по смертям.
Сейчас на ветке:
184,
Модераторов: 1,
Пользователей: 24,
Гостей: 102,
Ботов: 57
Archangel_
, BUR
, DeC
, Frodo
, MAPKOBKA
, Ol@
, R6790
, Wat
, Zameson
, _taras_
, didgik
, madmis1
, strannik-RF
, tomuchin
, Вадим Р.
, Дима23
, Ещё один инженер
, Константиныч
, Секешфехервар
, Сизиф
, Старгородский
, Старый дембель
, ТА49
, Шмухер
, воффка1