Альтернативная энергетика и энергосбережение
1,486,921
7,532
|
|
москвич ( Слушатель ) |
| 10 июн 2013 16:19:53 |
Тред №578735
новая дискуссия Дискуссия 249
Совместная группа ученых из США и Республики Корея открыли новый катализатор для реакций по восстановлению кислорода на основе частиц графена. Данная разработка позволит повысить эффективность топливных элементов и заменить графеновым катализатором ранее использовавшуюся для этих целей платину.
Топливные элементы вырабатывают электрический ток с помощью водорода, который является экологически чистым топливом. Не исключено, что в будущем ими оснастят транспортные средства — автомобили, самолеты и т. д. Необходимость использования платины в конструкциях элементов делает их довольно дорогостоящими.
В результате эксперимента выяснилось, что катализатор нового типа отличается большей стабильностью и успешно противостоит окиси углерода и метанолу, образующихся в процессе реакции. Получают катализатор путем обработки графита с добавлением молекул газа, которые впоследствии и связывают кислород.
Ученые пришли к выводу, что самым эффективным из всех опробованных вариантов является графен-йод. Так, после 10 тыс. циклов работы он обеспечивал производство электротока на уровне 85,6–87,4%, в то время как платина максимально выдавала 62,5%.
Источник: Ссылка
Топливные элементы вырабатывают электрический ток с помощью водорода, который является экологически чистым топливом. Не исключено, что в будущем ими оснастят транспортные средства — автомобили, самолеты и т. д. Необходимость использования платины в конструкциях элементов делает их довольно дорогостоящими.
В результате эксперимента выяснилось, что катализатор нового типа отличается большей стабильностью и успешно противостоит окиси углерода и метанолу, образующихся в процессе реакции. Получают катализатор путем обработки графита с добавлением молекул газа, которые впоследствии и связывают кислород.
Ученые пришли к выводу, что самым эффективным из всех опробованных вариантов является графен-йод. Так, после 10 тыс. циклов работы он обеспечивал производство электротока на уровне 85,6–87,4%, в то время как платина максимально выдавала 62,5%.
Источник: Ссылка
ОТВЕТЫ (3)
|
|
ДядяВася ( Слушатель ) |
| 10 июн 2013 23:17:05 |
Цитата: москвич от 10.06.2013 16:19:53
Учёные, оказались, ну очень скромные, не заметив как из водорода или кислорода получили аж углерод, а это не что иное как трансмутация элементов при земных условиях и без ядерного реактора или ускорителя. Срочно нужно писать в Нобелевский комитет.
|
|
Пацаки ( Слушатель ) |
| 13 июн 2013 21:31:09 |
Ага, журналистам, за достижения в лингвистике:Цитата: ДядяВася от 10.06.2013 23:17:05
Цитатамосквич, pronedra.ru
"В результате эксперимента выяснилось, что катализатор нового типа отличается большей стабильностью и успешно противостоит окиси углерода и метанолу, образующихся в процессе реакции. Получают катализатор путем обработки графита с добавлением молекул газа, которые впоследствии и связывают кислород."
т.е. канализаторы противостояли этанолу.
Этанол победил..
Расшифровка:
Дробили графит на однослойные графеновые наночастицы в шаровой мельнице, совместно с галогенами.
Получили вот это:

phys.org sciencedaily.com
Эта структура уменьшает энергию активации реакции:O2 + 4H+ + 4e -> 2H2O
Схема PEM - топливного элемента, на катоде - катализатор:
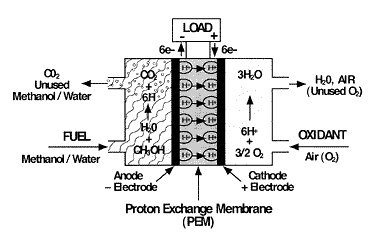 и далее:
и далее:"Тестирование катодов, покрытых нанопластинками галогенизированного графена, показало, что лучшие результаты демонстрирует сочетание графена и йода. Этот катализатор привел к повышению производства тока на 33% (по сравнению с коммерческим платиновым покрытием)."
" После 10 000 циклов работы электроды с графеном и йодом поддерживали от 85,6 до 87,4% от начального тока. Для платины этот показатель не превышает 62,5%. Кроме того, эффективность платиновых катализаторов резко падает в случае добавления угарного газа, а графен-йодный катализатор продемонстрировал устойчивость к нему. Как отмечает г-н Пэк, сейчас он и его коллеги работают над оптимизацией материала"innocom.ru (там тоже "переводчики")
Виды топливных элементов:
PEM -Топливные элементы с ионообменной мембраной
Отличительной особенностью PEM-элементов является применение графитовых электродов и твердополимерного электролита (или, как его еще называют, ионообменной мембраны — Proton Exchange Membrane). В качестве топлива в PEM-элементах используется чистый водород, а роль окислителя выполняет содержащийся в воздухе кислород. Водород подается со стороны анода, где происходит электрохимическая реакция:
2H2 -> 4H+ + 4e.
Ионы водорода перемещаются от анода к катоду через электролит (ионный проводник), в то время как электроны — через внешнюю цепь. На катоде, со стороны которого подается окислитель (кислород или воздух), происходит реакция окисления водорода с образованием чистой воды:
O2 + 4H+ + 4e -> 2H2O.
Рабочая температура PEM-элементов составляет около 80 °С. При таких условиях электрохимические реакции протекают слишком медленно, поэтому в конструкции элементов данного типа используется катализатор — обычно тонкий слой платины на каждом из электродов.
Одна ячейка такого элемента, состоящая из пары электродов и ионообменной мембраны, способна генерировать напряжение порядка 0,7 В. Для увеличения выходного напряжения массив отдельных ячеек соединяется в батарею.
PEM-элементы способны работать при относительно низкой температуре окружающей среды и обладают довольно высокой эффективностью (КПД составляет от 40 до 50%). В настоящее время на базе PEM-элементов созданы действующие прототипы энергоустановок мощностью до 50 кВт; в стадии разработки находятся устройства мощностью до 250 кВт.
Существует несколько ограничений, препятствующих более широкому распространению данной технологии. Это относительно высокая стоимость материалов для изготовления мембран и катализатора. Кроме того, в качестве топлива можно использовать только чистый водород.
Щелочные топливные элементы (Alkaline Fuel Cells, AFC)
Конструкция первого щелочного топливного элемента была разработана русским ученым П.Яблочковым в 1887 году. В качестве электролита в щелочных элементах используется концентрированный гидроксид калия (КОН) либо его водный раствор, а основным материалом для изготовления электродов является никель.
В качестве топлива применяется чистый водород, а качестве окислителя — чистый кислород. Реакция окисления водорода протекает через электроокисление водорода на аноде:
2H2 + 4OH– — 4e -> 4H2O
и электровосстановление кислорода на катоде:
O2 + 2H2O + 4e -> 4OH–.
Гидроксид-ионы двигаются в электролите от катода к аноду, а электроны — по внешней цепи от анода к катоду.
Щелочные элементы работают при температуре около 80 °С, однако значительно (примерно на порядок) уступают PEM-элементам по удельной мощности, вследствие чего их габариты (при сравнимых характеристиках) значительно больше. Однако себестоимость производства щелочных элементов значительно ниже, чем PEM. Основной недостаток щелочных элементов заключается в необходимости использования чистых кислорода и водорода, поскольку содержание в топливе или окислителе примесей углекислого газа (CO2) приводит к карбонизации щелочи.
Фосфорнокислые топливные элементы (Phosphoric Acid Fuel Cells, PAFC)
В качестве электролита в фосфорнокислых элементах используется жидкая фосфорная кислота, обычно заключенная в порах матрицы из карбида кремния. Для изготовления электродов применяется графит. Происходящие в фосфорнокислых элемента реакции электроокисления водорода аналогичны тем, которые протекают в PEM-элементах.
Рабочая температура фосфорнокислых элементов несколько выше по сравнению с PEM- и щелочными и колеблется в пределах от 150 до 200 °С. Тем не менее для обеспечения необходимой скорости электрохимических реакций необходимо использовать катализаторы (платину либо сплавы на ее основе). Благодаря более высокой рабочей температуре фосфорнокислые элементы менее чувствительны к химической чистоте топлива (водорода), чем PEM- и щелочные элементы. Это позволяет применять топливную смесь, содержащую 1-2% оксида углерода. В качестве окислителя можно использовать обычный воздух, поскольку содержащиеся в нем вещества не вступают в реакцию с электролитом.
Фосфорнокислые элементы обладают относительно невысоким КПД (порядка 40%) и требуют некоторого времени для выхода на рабочий режим при холодном старте. Однако PAFC имеют и целый ряд преимуществ, в том числе более простую конструкцию, а также высокую стабильность и низкую летучесть электролита.
В настоящее время на базе фосфорнокислых элементов создано и запущено в коммерческую эксплуатацию большое количество энергоустановок мощностью от 200 кВт до 20 МВт.
Топливные элементы с прямым окислением метанола (Direct Methanol Fuel Cells, DMFC)
Элементы с прямым окислением метанола являются одним из вариантов реализации элементов с ионообменной мембраной. Топливом для DMFC-элементов служит водный раствор метилового спирта (метанола). Необходимый для реакции водород (и побочный продукт в виде углекислого газа) получается за счет прямого электроокисления раствора метанола на аноде:
CH3OH + H2O -> CO2 + 6H+ + 6e.
На катоде происходит реакция окисления водорода с образованием воды:
3/2O2 + 6H+ + 6e -> 3H2O.
Рабочая температуры DMFC-элементов составляет примерно 120 °С, что немного выше по сравнению с водородными PEM-элементами. Недостатком низкотемпературного преобразования является более высокая потребность в катализаторах. Это неизбежно приводит увеличению стоимости таких топливных элементов, однако данный недостаток компенсируется удобством использования жидкого топлива и отсутствием необходимости в применении внешнего конвертора для получения чистого водорода.
Топливные элементы с электролитом из расплава карбоната лития и натрия (Molten Carbonate Fuel Cells, MCFC)
Данный тип топливных элементов относится к высокотемпературным устройствам. В них применяется электролит, состоящий из карбоната лития (Li2CO3) либо карбоната натрия (Na2CO3), находящегося в порах керамической матрицы. В качестве материала для анода используется никель, легированный хромом, а для катода — литированный оксид никеля (NiO + LiO2). При нагревании до температуры порядка 650 °С компоненты электролита расплавляются, в результате чего образуются ионы углекислой соли, движущиеся от катода к аноду, где они вступают в реакцию с водородом:
CO32– + H2 -> H2O + CO2 + 2e.
Высвободившиеся электроны движутся по внешней цепи обратно к катоду, где происходит реакция:
CO2 + 1/2 O2 + 2e -> CO32–.
Высокая рабочая температура данных элементов позволяет применять в качестве топлива природный газ (метан), преобразуемый встроенным конвертором в водород и монооксид углерода:
CH4 + H2O CO + 3H2.
MCFC-элементы обладают высоким КПД (до 60%) и позволяют использовать в качестве катализатора не платину, а более дешевый и доступный никель. Вследствие большого количества выделяемого при работе тепла данный вид топливных элементов хорошо подходит для создания стационарных источников электрической и тепловой энергии, однако малопригоден для эксплуатации в мобильных условиях. В настоящее время на базе MCFC-элементов уже созданы стационарные энергоустановки мощностью до 2 МВт.
Топливные элементы с твердым электролитом (Solid Oxide Fuel Cells, SOFC)
Данный тип элементов имеет еще более высокую рабочую температуру (от 800 до 1000 °С), чем вышеописанный MCFC. В SOFC применяется керамический электролит на основе оксида циркония (ZrO2), стабилизированного оксидом иттрия (Y2O3). На катоде происходит электрохимическая реакция с образованием отрицательно заряженных ионов кислорода:
O2 + 4e -> 2O2–.
Отрицательно заряженные ионы кислорода движутся в электролите по направлению от катода к аноду, где происходит окисление топлива (обычно — смеси водорода с монооксидом углерода с образованием воды и углекислого газа:
H2 + 2O2– -> H2O + 2e;
CO + 2O2– -> CO2 + 2e.
Элементы типа SOFC обладают теми же достоинствами, что и MCFC, включая возможность использования в качестве топлива природного газа. Компоненты SOFC обладают более высокой химической стабильностью, однако себестоимость их производства несколько выше по сравнению с MCFC.
Ссылка
|
|
ДядяВася ( Слушатель ) |
| 13 июн 2013 23:00:21 |
Вы как то забыли с чего начиналась Ваша ссылка:
"Топливные элементы вырабатывают электрический ток с помощью водорода, который является экологически чистым топливом. Не исключено, что в будущем ими оснастят транспортные средства — автомобили, самолеты и т. д. Необходимость использования платины в конструкциях элементов делает их довольно дорогостоящими."
На что, собственно, я и обратил внимание. А далее, по ходу Вашей ссылки получалось, что из водорода и кислорода получается и СО и метанол. Что и вызвало лёгкое недоумение.
А то, что в качестве топлива, вообще, в топливных элементов используют и метанол, откровением не является.
